SCR-Selective Catalytic Reduction
Nell’immaginario comune, in particolar modo negli ultimi anni, il sostantivo inquinante è andato via via diluendosi nelle masse gassose di anidride carbonica emesse in atmosfera da attività umane e non. Ora, se è vero che è certamente possibile parlare del biossido di carbonio (CO2) come inquinante, altre sostanze possono essere ugualmente drappeggiate. Nello specifico, principalmente in ambito di combustione, possiamo distinguere tre famiglie di inquinanti. Al di là del particolato e della sua estrema eterogeneità fisico-chimica e della famiglia degli SOx, ci focalizziamo sugli NOx che presentano un’interazione con l’ambiente, nonché con l’uomo, estremamente delicata.
NOx, caratteristiche e origine
Sotto la denominazione di NOx rientrano tutti i cosiddetti ossidi di azoto, ovvero sostanze chimiche quali il monossido di azoto (NO), il biossido di azoto (NO2), l’ossido di diazoto (N2O) e tutte quelle intuitivamente ottenibili giocando con un certo criterio chimico alla dissezione e al successivo ri-assemblaggio dell’ossigeno e dell’azoto molecolari (N2O3, N2O5, ecc ecc). Nello specifico queste sostanze hanno tutte proprietà fisico-chimiche, effetti nella loro interazione con l’uomo e/o con l’ambiente, nonché metodologia di trattamento differenti . In tempi recenti, inoltre, è di dibattito scientifico la possibilità che le particelle inquinanti possano essere vettori per il virus Sars-CoV-2.
Il monossido di azoto (NO) è un gas incolore altamente pericoloso per l’uomo: irritante per gli occhi e per le vie respiratorie, se in contatto col sangue porta alla formazione di metaemoglobina, forma emoglobina con il Ferro nello stato 3+ e non 2+, e impossibilitata, quindi, al legame con l’ossigeno molecolare proveniente dalla respirazione ed al successivo trasporto di questo ai tessuti corporei; ciò comporta l’asfissia e la successiva morte degli stessi.
Il biossido di azoto (NO2) è un gas dal colorito rosso-bruno che si presenta maggiormente denso, a temperatura ambiente, dell’aria, depositandosi, quindi, nello strato inferiore dell’atmosfera. Questo gas è irritante per le vie respiratorie umane e causa convulsioni nonché insufficienza respiratoria.
L’ossido di diazoto (N2O) non è pericoloso per l’uomo in senso diretto, anzi, è il cosiddetto gas esilarante utilizzato in campo medico come anestetico. Tuttavia è un gas serra fra i più importanti presentando, certamente, minori emissione in atmosfera rispetto, ad esempio, alla CO2, ma capacità di schermo, quindi un potenziale serra, ben maggiore.
Gli NOx sono prodotti della reazione chimica di combustione, quindi, data l’evidente dipendenza dell’uomo dal processo per l’ottenimento di energia utilizzabile, sono prodotti piuttosto comuni fra quelli immessi in atmosfera. In un processo combustivo, sono tre i meccanismi che portano alla formazione degli NOx e, quindi, tre le categorie degli ossidi di azoto: i Thermal-NOx sono gli ossidi che si formano per la dissociazione, ad elevate temperature (T>2000°C), dell’azoto molecolare introdotto nella zona di combustione quale parte dell’aria comburente e dell’ossigeno della stessa che non partecipa al fenomeno combustivo; i Fuel-NOx sono gli ossidi che si formano in virtù della presenza di azoto nel combustibile stesso, ad esempio per la presenza di elementi ammoniacali (NH2,NH3); i prompt-NOx quelli che si formano dall’interazione , innescata dall’energia rilasciata durante il processo, fra l’azoto molecolare dell’aria comburente e idrocarburi incombusti del combustibile.
NOx e impianti di produzione energetica
Comprendere i meccanismi di formazione degli NOx è essenziale per lo sviluppo dei successivi processi di rimozione, poiché sono possibili interventi mirati alla diminuzione di una tipologia piuttosto che di un’altra, magari preponderante; non soltanto: alcune tipologie di NOx potrebbero risultare del tutto assenti in determinati contesti industriali. In un impianto a gas le temperature del gas in uscita dalla camera di combustione sono dell’ordine di 1300 °C e quindi all’interno della c.c. possono essere raggiunti anche i 2000°C, aspetto che determina una massiccia formazione di Thermal-NOx; tuttavia l’impiego di combustibili pregiati quali il metano (CH4) implica la totale assenza di Fuel-NOx e di Prompt-NOx. Per questo motivo sarà premura del progettista intercettare la produzione dei Thermal-NOx all’interno della c.c. stessa senza predisporre un organo dedicato a valle della combustione.
Negli impianti a vapore, invece, le temperature in gioco sono modeste se rapportate agli impianti a gas; tuttavia il vantaggio di questi sistemi è la possibilità di impiego di combustibili di scarso pregio, con il conseguente enorme risparmio sui costi di gestione. Chiaramente questo comporta una maggiore produzione di inquinanti ( NOx, SOx, CO2, particolato), spostando quindi il discorso dalla gestione economica all’impatto ambientale di questi sistemi produttivi.
In un impianto a vapore le temperature in gioco e l’impiego di caldaie con immissione di aria o combustibile frazionate determina una modesta produzione di Thermal-NOx, ma non risulta possibile ridurre più di tanto, a monte della combustione, la formazione di Fuel-NOx e Prompt-NOx. Sono infatti possibili lavaggi e altri processi, tuttavia questi comportano un aggravio notevole dei costi di gestione, aspetto, questo, in conflitto con la maggiore economicità nella gestione degli Impianti Vapore rispetto agli altri sistemi produttivi. Per tale motivo in tutti gli IV sono presenti organi in grado di trattare e rimuovere gli NOx a valle della combustione, i cosiddetti SCR.
SCR-Selective Catalityc Reduction
I Selective Catalityc Reduction sono sistemi di trattamento di NOx in cui questi vengono fatti reagire con un elemento riduttore, generalmente ammoniaca (NH3), in presenza di un catalizzatore, col fine di ridurre gli NOx, ovvero sottrarre questi l’ossigeno e formare nuovamente acqua e azoto molecolare. Le reazioni chimiche possono essere ridotte fondamentalmente a due, ovvero: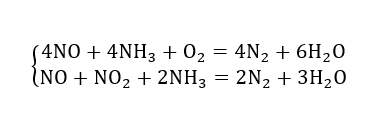
Il primo aspetto importante è il rapporto 1:1 fra i reagenti e l’ammoniaca, ciò che implicherebbe il vantaggio di lavorare senza eccesso di ammoniaca in condizioni perfette. L’ammoniaca non soltanto è costosa, ma anche dannosa per l’uomo e lavorare con la giusta quantità è un vantaggio non indifferente. Queste reazioni avvengono in presenza di un catalizzatore in un range di temperature 300°C-400°C. La temperatura deve essere strettamente controllata poiché al di fuori di questo intervallo insorgono effetti indesiderati. Nello specifico al di sotto dei 300 °C la cinetica della combustione risulta troppo lenta, con conseguente presenza, allo scarico, non soltanto di NOx ma anche di NH3. Al di sopra dei 400°C viene favorita, tanto più è alta la temperatura di esercizio, la reazione di formazione degli stessi NO a partire dall’ossigeno molecolare e dell’ammoniaca, la cui molecola va incontro a un processo di dissociazione, in quanto termicamente sollecitata, secondo la reazione:
![]()
Allo stesso tempo, a elevate temperature, viene fortemente favorita la reazione fra gli SOx e l’ammoniaca attraverso la reazione:
![]()
Il solfato d’ammonio ((NH4)2SO4) è un sale dal colore biancastro-incolore che si deposita sulle pareti del catalizzatore, impedendo, di fatto, a questo di favorire le reazioni necessarie alla sottrazione degli NOx dalla corrente gassosa, imponendo cioè un effetto schermo (NOx, NH3). Tuttavia, fintanto che la reazione avviene all’interno del range ti temperatura ottimale, il processo di rimozione degli NOx tramite SCR risulta piuttosto performante, con rendimenti dell’ordine del 90%.

Fig. 2- Esempio di SCR
Architetture impiantistiche
Il punto critico circa l’impiego degli SCR è dunque sulla temperatura, poiché le condizioni di esercizio ottimali vengono raggiunte in un intervallo piuttosto breve. Allo stesso tempo è bene notare come queste condizioni siano, comunque, non facili da ottenere all’interno di un circuito di trattamento dei gas combusti in uscita da un impianto a vapore. Per ottenere queste è possibile posizionare l’SCR immediatamente a valle della caldaia, ciò che costituisce l’architettura High-Dust. Il posizionamento dell’SCR di seguito alla caldaia consente il raggiungimento delle temperature ottimali senza problemi, o complicazioni circuitali. Tuttavia nell’SCR entra un gas sporco, ricco di particolato e SOx. Il particolato, la cui particella risulta ben più grande, su scala microscopica, rispetto a una molecola, sia questa di NOx che di SOx, finisce con lo schermare le molecole di NOx e di NH3, ostacolando la reazioni. Allo stesso tempo la presenza degli SOx, preponderanti in concentrazione rispetto agli NOx, porta alla formazione di (NH4)2SO4. Tutto questo rende necessaria l’introduzione di ammoniaca in eccesso, quindi presente allo scarico; oppure condizioni operative con il corretto quantitativo di ammoniaca ma con prestazioni ben inferiori. All’SCR segue poi il sistema di rimozione del particolato e, infine, l’FGD.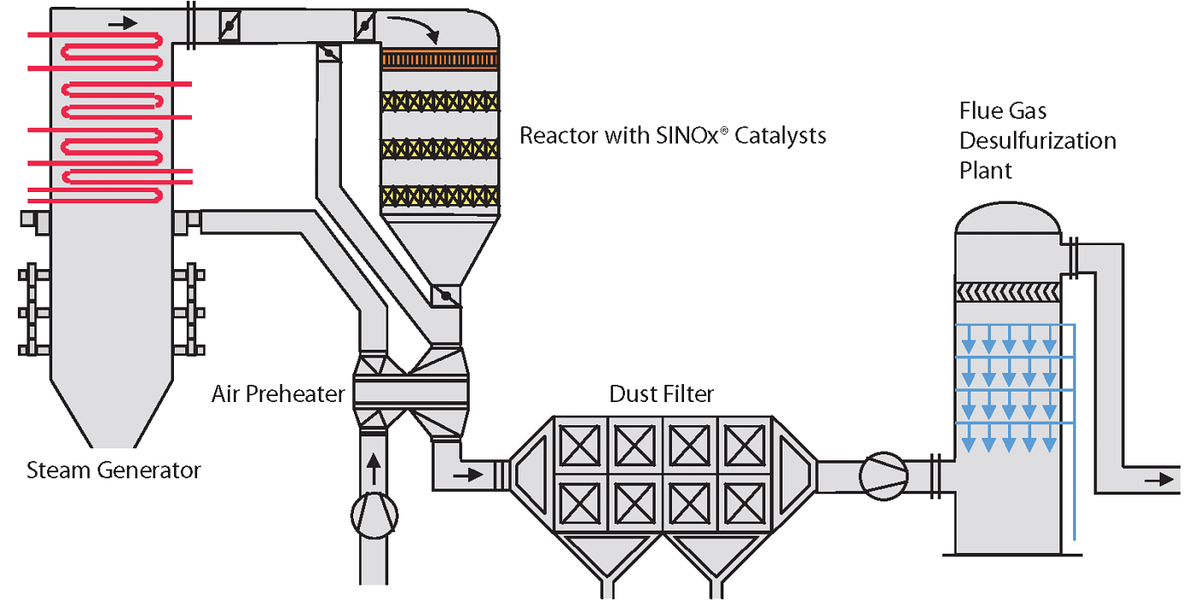
Fig.3- Architettura High-Dust
Per risolvere almeno il problema della presenza del particolato, che determina una marcata diminuzione delle prestazioni dell’SCR, è proposta l’architettura Low-Dust, in cui a valle della caldaia è posizionato il sistema di trattamento del particolato. Chiaramente, visto che a monte del sistema di rimozione del particolato è posizionato l’SCR, che richiede elevate temperature, troviamo grosse limitazioni sul sistema di rimozione del particolato possibile da impiegare, dovendo ricorrere a soluzioni costose ( nello specifico risulta impossibile impiegare un filtro a maniche). In questa architettura persiste, tuttavia, il problema della presenza degli SOx, concorrenziali agli NOx, nella reazione con l’ammoniaca.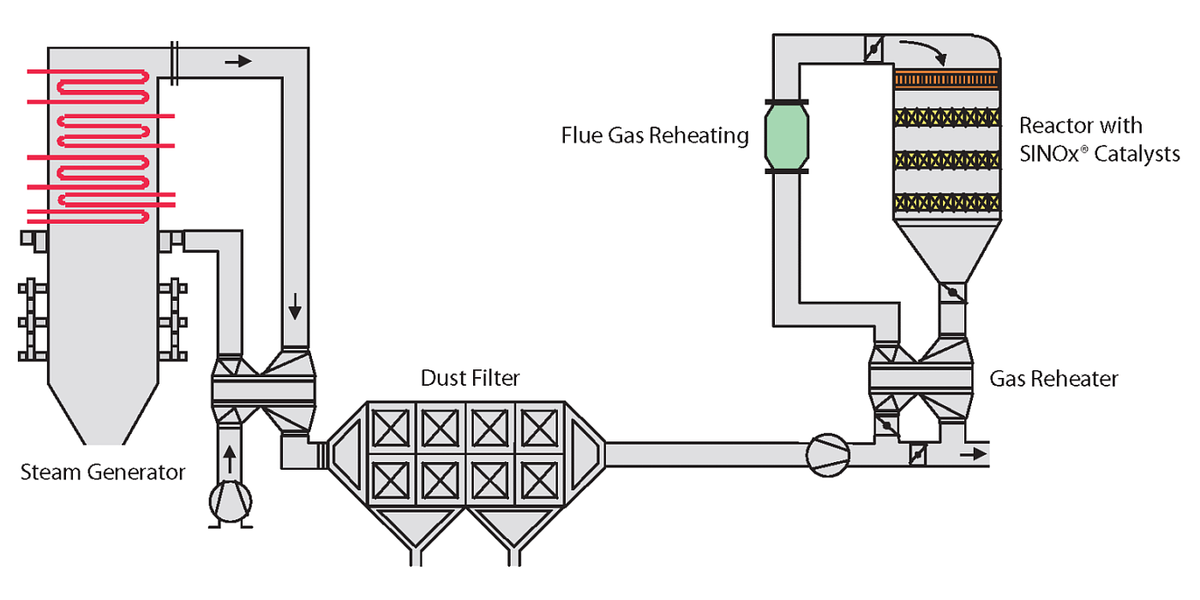
Fig.4-Architettura Low-Dust
Per la risoluzione di tutti questi problemi, è stata proposta una terza e maggiormente performante architettura la Tail-End. A valle della camera di combustione è presente un pre-riscaldatore di aria e, quindi, un sistema di rimozione del particolato, segue un FGD, predisposto alla rimozione degli SOx, e, poi, dopo un’ulteriore combustione, atta a riportare la temperatura dei gas combusti trattati nell’intervallo di temperatura ottimale per le reazioni, l’SCR. Ovviamente la combustione non deve portare nuovamente alla formazione di particolato e/o SOx, richiesta espletabile mediante il metano. L’architettura impiantistica risulta ovviamente aggravata, soprattutto se viene predisposta la presenza di un ulteriore scambiatore a superficie immediatamente a valle dell’FGD, e quindi ben maggiori i costi iniziali; tuttavia ogni organo presente lavora nelle condizioni operative ottimali.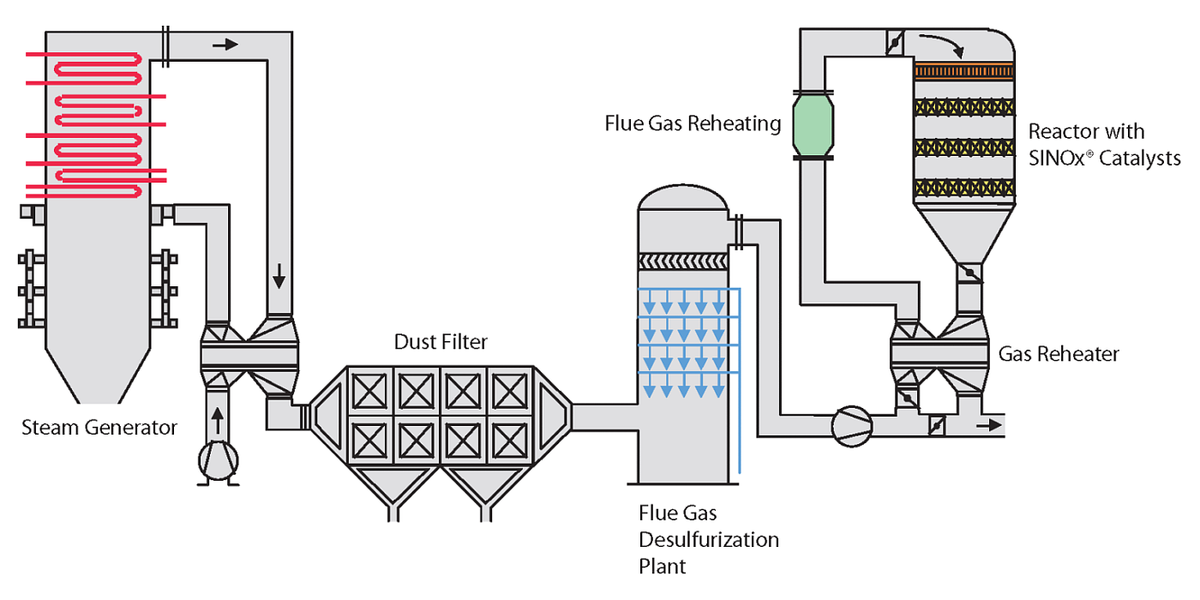
Fig. 5- Architettura Tail-End
In conclusione la tecnologia SCR, ormai consolidata da decenni nell’applicazione e nello sviluppo tecnologico, si presenta estremamente affidabile, raggiungendo la rimozione degli NOx percentuali buone, attorno al 80-85%, anche se non paragonabili alle percentuali dei sistemi di rimozione del particolato ( fino al 98%) e degli SOx (attorno al 90%), nonché rappresentando un costo di investimento relativamente modesto, attorno al 6% dell’intero costo d’investimento impiantistico, se paragonato, ad esempio, ai sistemi di rimozione degli SOx (10%).
Bibliografia consultata
Sang-Hee Jo, Kyeong Mok Kim, Seo Hee Seo, Tae-Hun Kim, Seungho Yu, Tak-Hyun Kim, Youn-Suk Son , A study on additives to improve electron beam technology for NOx and SO2 reduction, Radiation Physics and Chemistry 183, ElSevier, 2021.
W.S. Kijlstra, D. S. Brands, H. I. Smit, E. K. Poels, A. Bliek , Mechanism of the Selective Catalytic Reduction of NO with NH3 over MnOx/Al2O3 , Journal of Catalysis 171 (219-230), ElSevier, 1997.
G. Busca, L. Lietti, G. Ramis, F. Berti, Chemical and mechanistic aspects of the selective catalytic reduction of NOx by ammonia over oxide catalysts: A review, Applied Catalysis B: Environmental 18 (1-36), ElSevier, 1998.
M. Koebel, G. Madia, M. Elsener, Selective catalytic reduction of NO and NO2 at low temperatures, Catalysis Today 73 (239-247), ElSevier, 2002.
Catalysts for the selective catalytic reduction of NOx with NH3 at low temperature, Catalysis Science & Technology 9.