CCU-Carbon Capture and Utilization
L’anidride carbonica è uno dei maggiori prodotti delle attività antropiche e non, nonché uno dei gas maggiormente delicati per quanto riguarda la sua interazione con l’ambiente. Esistono, tuttavia, processi in grado di utilizzare questa sostanza in contesti industriali, riducendo, così, le emissioni e attenuando le tragiche conseguenze di queste.
Carbon Capture and Utilization
Il biossido di carbonio, ciò che comunemente chiamiamo anidride carbonica, si presenta particolarmente stabile, chimicamente parlando, grazie al doppio legame covalente fra l’atomo di carbonio e i due di ossigeno, nonché inerte; fisicamente incolore, inodore e atossica, risulta coinvolta in numerosi processi naturali quali la fotosintesi, l’effetto serra e la respirazione. A differenza di quanto si possa pensare intuitivamente, quindi, la CO2, non risulta pericolosa per l’uomo in senso diretto, poiché naturalmente presente in atmosfera, seppure in basse concentrazioni, e coinvolta in processi fondamentali per la vita; lo risulta, però, indirettamente, in quanto uno dei più importanti gas serra, nonché, tra questi, quello preponderante in termini di immissione da attività umane. Proprio la forte e continua emissione di CO2 ha portato nel tempo, e continua tutt’oggi a portare, a un incremento della concentrazione di questa in atmosfera e, quindi, a un incremento dell’effetto serra, essendo anche questo, altrimenti, un fenomeno del tutto naturale e presente in ogni pianeta provvisto di atmosfera, atto alla regolazione della Temperatura del pianeta stesso.
I dati sull’immissione in atmosfera legata al settore energetico non sono incoraggianti, per usare un eufemismo, per quel che concerne l’ultimo trentennio: nonostante la tendenza relativa al 2019 e la sicura diminuzione delle emissioni nel 2020, come conseguenza della pandemia, dal 1990 s’è assistito a un grande aumento delle emissioni, nonostante la tendenza a ribasso per quel che concerne le economie sviluppate, impegnate in una graduale, seppur lenta, transizione energetica verso produzioni maggiormente green. Particolarmente interessante è poi notare l’incremento delle emissioni da combustione di elementi fossili, cresciute nell’ultimo ventennio.
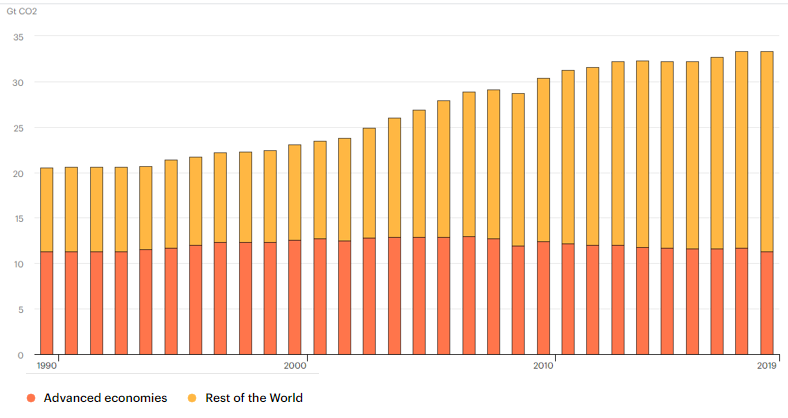 Fig. 1-Grafico emissioni anidride carbonica rispetto alla produzione energetica mondiale
Fig. 1-Grafico emissioni anidride carbonica rispetto alla produzione energetica mondiale
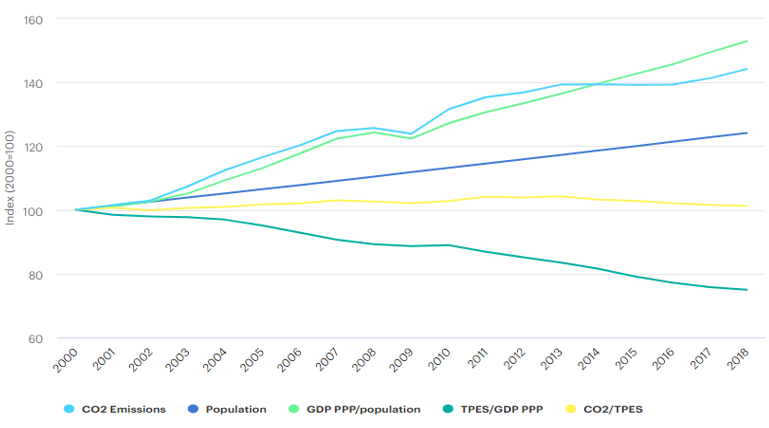 Fig. 2-Grafico sulle emissioni di anidride carbonica da combustione di combustibili fossili
Fig. 2-Grafico sulle emissioni di anidride carbonica da combustione di combustibili fossili
Quindi, cosa fare della CO2? Guardando limitatamente, non-ossimoricamente parlando, alla produzione di questa per mezzo della combustione, appare evidente la portata del problema, non potendosi di certo convertire, nell’immediato, tutte le caldaie, le camere di combustione e i motori all’impiego di idrogeno, la cui sola combustione (ma non i processi da cui può essere ricavato) risulta esente dalla produzione di CO2 . Volumetricamente l’emissione è enorme, gargantuesca. Tuttavia, il problema di fondo sta nell’impossibilità, date gli attributi fisico-chimici precedentemente sciorinati, di sfruttare la CO2 energeticamente; cioè, prendere da questa l’energia retaggio del processo chimico di combustione. Allo stesso tempo lo stoccaggio è si possibile, certamente, ma necessita di un intermedio processo di liquefazione, dispendioso energeticamente parlando, poiché necessarie la compressione e il raffreddamento del gas.
In un qualsiasi sistema produttivo di beni e/o servizi, un elemento prodotto, e non soltanto quello al cui ottenimento il sistema produttivo stesso risulta finalizzato, deve essere inteso come una risorsa da sfruttare, al fine di minimizzare i costi, massimizzare i rendimenti e la produzione. Soltanto lì dove un elemento non trova ri-utilizzo o adeguato impiego all’interno del sistema produttivo si dovrebbe parlare di scarto. Per affrontare il problema della CO2 all’interno del sistema industriale, quindi, risulta necessario cambiare prospettiva: domandarsi, cioè, come sfruttare la presenza del biossido di carbonio fra i prodotti della reazione di combustione e, soprattutto, come utilizzarla o ri-utilizzarla all’interno dello stesso tessuto industriale, anche in un ambito differente da quello in cui è stata prodotta, trovargli, cioè, una seconda finalità. Attraverso questa lente è, perciò, possibile trattarla come un elemento mezzano per ottenerne altri, reagente per differenti prodotti, possibilità offerta dalla presenza dell’atomo di carbonio, elemento chiave in una grande quantità di processi.
È bene notare che nelle soluzioni qui presentate, la CO2 verrà sempre pensata separata dagli altri gas combusti frutto della reazione per mezzo di vari e più o meno performanti, a seconda del caso, metodi di separazione e rimozione di gas da una miscela.
Riutilizzo dell’anidride carbonica
Metanazione
Uno dei processi maggiormente diffusi per il riutilizzo dell’anidride carbonica in sede industriale è quello della metanazione, che, spogliato di ogni complessità tecnica e riportato all’originale semplicità concettuale, consiste nel ricavare nuovamente metano a partire dalla CO2.
Se quindi nella combustione del metano viene prodotta anidride, in questo processo è sfruttata quest’ultima per ottenere nuovamente metano, rappresentando questo un esempio di economia circolare (CH4-CO2-CH4), in quanto si torna all’elemento di partenza sfruttando i prodotti del trattamento dell’elemento iniziale stesso. Tuttavia, concettualmente parlando la metanazione non può di certo essere considerata come il processo inverso della combustione, notoriamente reazione chimica non-invertibile per eccellenza; può essere invece considerato come il processo inverso allo Steam reforming, in cui un idrocarburo di partenza, quale ad esempio lo stesso metano, viene lavorato con vapore ad alta temperatura e pressione al fine di ricavare un gas di sintesi (syngas) composto da idrogeno e monossido di carbonio.
Nella Metanazione la reazione chimica che avviene è la seguente: 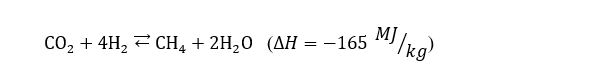
Come si evince dal bilancio energetico, la reazione risulta essere decisamente endotermica, cioè necessita di una sostanziosa quantità di energia per avvenire. Per tale motivo il reattore, che prende il nome di reattore Sabatier è catalitico, mentre la temperatura di esercizio ricade in un intervallo di valori compreso fra 300° e 400°.
La metanazione è sicuramente uno dei più performanti, al netto di costi di esercizio non indifferenti. Il problema sostanziale, tuttavia, sta nel ricavare l’idrogeno necessario alla reazione, poiché scarsamente presente allo stato molecolare e disponibile invece legato nell’acqua e in composti organici, elementi, quindi, da trattare con processi più o meno complessi. Nello specifico si fa riferimento a processi di gassificazione di elementi organici, quali idrocarburi (l’inverso della metanazione, lo steam reforming, è un processo di gassificazione), il che porterebbe, però, alla formazione di nuova e ulteriore anidride carbonica; e all’idrolisi, ovvero la scissione delle molecole di acqua, processo energeticamente molto costoso.
Il reale vantaggio della metanazione consiste nel fatto che offre una seconda vita all’energia non sfruttata. Se guardiamo alla realtà tecnologica attuale, l’energia elettrica, una volta immessa nella rete, può essere, da questa, soltanto distribuita ma non conservata; conservazione che non può avvenire, con elevati rendimenti se non per modesti quantitativi energetici e, comunque, per periodi temporali piuttosto brevi (a differenza dello stoccaggio del calore). Il problema dello spreco dell’energia elettrica, però, diventa pressante lì dove questa è prodotta mediante risorsa rinnovabile: la risorsa sfruttata ha un andamento variabile nel tempo, oscillatorio che non può essere controllato; ciò comporta che, nei momenti di grande disponibilità della risorsa, c’è una sovrapproduzione di energia elettrica, eccedente la richiesta del carico (utenza) e, quindi, lo spreco di parte di questa mediante la messa a terra. Questa energia in surplus, però, potrebbe essere sfruttata nei processi di idrolisi e, quindi, come finanziatrice indiretta del più complesso sistema della metanazione. L’energia altrimenti sprecata viene immagazzinata nell’H2, c’è uno stoccaggio sostitutivo nel potenziale energetico dell’idrogeno e non diretto in dispositivi di conservazione.
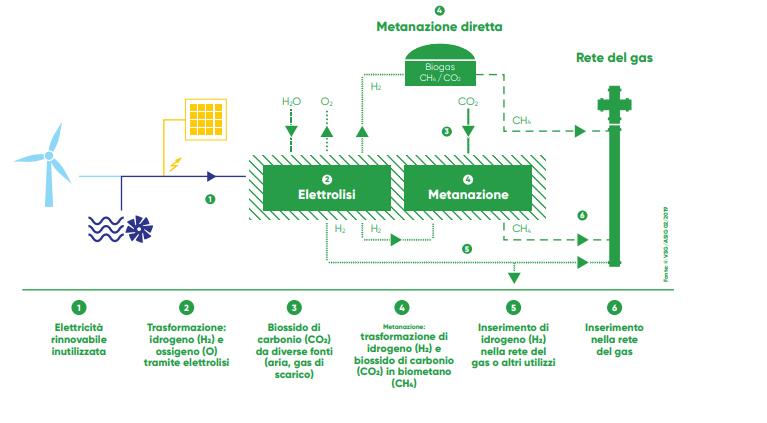 Fig. 3- Schema riutilizzo energia elettrica da fonte rinnovabile per metanazione CO2
Fig. 3- Schema riutilizzo energia elettrica da fonte rinnovabile per metanazione CO2
Idrogenazione
Processo alternativo alla metanazione è quello dell’idrogenazione: se nel primo dalla CO2 c’è un ritorno al metano, nell’anidride è un tassello intermedio per ricavare metanolo, sostanza particolarmente versatile sia come combustibile che come reagente per ricavare altri e ulteriori terzi prodotti. Le reazioni chimiche di riferimento sono le seguenti: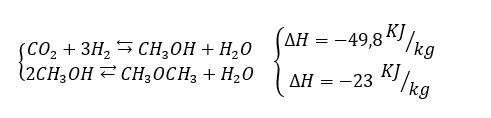
Chiaramente la prima reazione è alternativa al processo di metanazione, essendo, d’altronde, energeticamente più conveniente, ragion per cui favorita a basse temperature e pressioni.
Il metanolo (CH3OH) ha il vantaggio di essere liquido, ciò che ne consente un facile stoccaggio, nonché il trasporto attraverso grosse navi cisterna o mezzi su gomma. Oltre all’impiego come combustibile, può essere impiegato per ricavare formaldeide e acido acetico.
Nel secondo processo riportato il metanolo si scinde in DME (Dimetiletere) e acqua, DME particolarmente interessante e promettente come combustibile. Il vantaggio sta nel fatto che questo può essere ricavato a partire da gas naturale (passando per il metanolo) a costi relativamente bassi e, soprattutto lì dove non esista una rete produttiva in grado di lavorare con gas naturale o un mercato sufficientemente sviluppato di questo, rappresenta un’ottima alternativa. Come combustibile può essere sfruttato da solo, oppure in una miscela DME/GPL, miscela che presenterebbe un PCI maggiore rispetto al solo GPL. Inoltre, può essere adoperato come propellente, al posto del CFC (clorofluorocarburi), non comportando problemi nell’interazione con l’atmosfera, quale l’impatto sullo strato di ozono.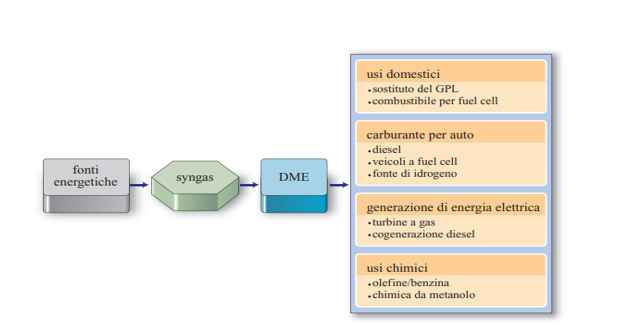 Fig. 4-Possibili utilizzi DME
Fig. 4-Possibili utilizzi DME
È bene notare che le due reazioni risultano fra loro concorrenziali, ragion per cui, a seconda del prodotto ricercato va favorita l’una o l’altra. Questo passa dall’impiego del giusto catalizzatore.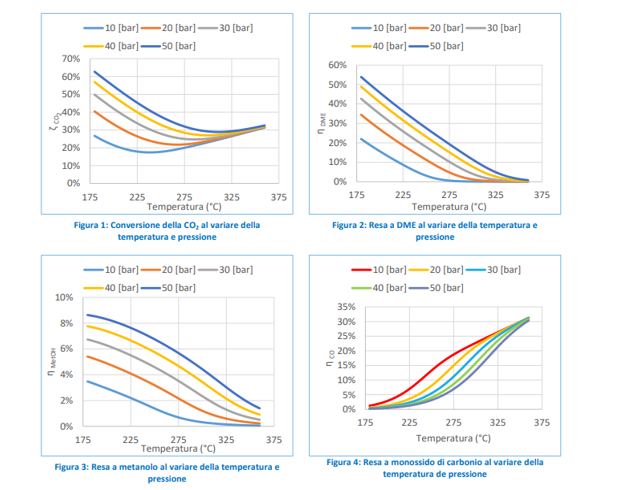 Fig. 5-Grafici rese Metanolo-DME in funzione delle variabili di pressione e temperatura
Fig. 5-Grafici rese Metanolo-DME in funzione delle variabili di pressione e temperatura
Fischer-Tropsch
Un altro processo è quello di fischer-tropsch che consente di ricavare paraffine facendo, anche qui, reagire la CO2 con l’idrogeno, secondo il processo:
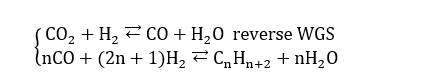 La prima reazione riportata è la reazione inversa della Water-Gas shift, processo che consente di ottenere idrogeno a elevata purezza a partire da un combustibile, generalmente solido, e da acqua. Il WGS trova costante e necessaria applicazione negli impianti con trattamento pre-combustione, cioè quegli impianti in cui s’agisce al fine di rimuovere la CO2 prima della combustione. Chimicamente parlando il monossido di carbonio viene ridotto a CO2 per opera dell’idrogeno in presenza di un catalizzatore, generalmente un ossido di cobalto o di magnesio, in un intervallo di temperature 170°-220°.
La prima reazione riportata è la reazione inversa della Water-Gas shift, processo che consente di ottenere idrogeno a elevata purezza a partire da un combustibile, generalmente solido, e da acqua. Il WGS trova costante e necessaria applicazione negli impianti con trattamento pre-combustione, cioè quegli impianti in cui s’agisce al fine di rimuovere la CO2 prima della combustione. Chimicamente parlando il monossido di carbonio viene ridotto a CO2 per opera dell’idrogeno in presenza di un catalizzatore, generalmente un ossido di cobalto o di magnesio, in un intervallo di temperature 170°-220°.
Le paraffine sono miscele di idrocarburi le cui molecole presentano una catena particolarmente lunga, che può arrivare a contare fino a 20 atomi di carbonio. Fisicamente parlando è traslucida, insapore, inodore e untuosa al tatto, trova numerose e trasversali, nonché versatili, applicazioni: come materiale di stoccaggio del calore, anche se con prestazioni mediocri a fronte, però, di costi piuttosto modesti; nella fabbricazione delle candele se addizionata con particolari acidi; nella fabbricazione di articoli impermeabili poiché insolubile in acqua; nella cosmetica e nella produzione di combustibili soprattutto. È bene evidenziare che le paraffine possono risultare particolarmente nocive per la salute se non sufficientemente raffinate. Il grado di purezza e, indirettamente, l’indice della pericolosità lo restituisce il colore.
Produzione urea e iniezione in giacimenti petroliferi
Ulteriormente la CO2 può essere impiegata come tassello intermedio nei processi industriali per la produzione dell’urea; a sua volta elemento mediano per la produzione di fertilizzanti. Nello specifico l’urea viene ottenuta a partire dal carbonato di ammonio, a sua volta ottenuto dalla reazione di anidride e ammoniaca. Le reazioni sono quelle qui sotto riportate: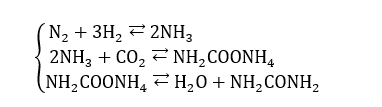
L’urea, che normalmente si presenta come cristalli incolore, ha parecchi impieghi, al di là della produzione industriale di fertilizzanti. Particolarmente importante è l’impiego di questa in diversi processi per l’abbattimento delle emissioni delle specie chimiche inquinanti. È particolarmente utilizzata per la riduzione delle emissioni degli NOx , sia nelle marmitte catalitiche di mezzi pesanti a motore Diesel, sia negli impianti industriali di rimozione degli ossidi di azoto, gli SCR (Selective Catalytic Reduction).
Il biossido può essere utilizzato direttamente in altri processi, e non soltanto come intermezzo chimico, nell’estrazione di combustibili fossili quali il petrolio, iniettata ad alta pressione in giacimenti. Sotto questo punto di vista i giacimenti esauriti diventano siti di stoccaggio potenzialmente ottimi. Recenti studi hanno dimostrato come risulti particolarmente performante l’iniezione successivo confinamento in giacimenti sottomarini per mezzo delle piattaforme. Tuttavia, ambo i processi, iniezione per estrazione o confinamento diretto, richiedono anidride allo stato liquido, e quindi diventa economicamente svantaggioso se presente questa in fase gassosa. Allo stesso tempo si noti come un problema essenziale è la mancanza di reti di distribuzione attraverso condutture, strutture simili ai metanodotti, in grado di garantire lo spostamento da un sito a un altro, ciò che renderebbe necessario, quindi il trasporto su gomma, nella maggior parte dei casi, e la probabile immissione di ulteriore CO2. Alla luce di questo appare chiaro come l’impiego dell’anidride come sostanza mediana in processi chimici è sicuramente la migliore soluzione.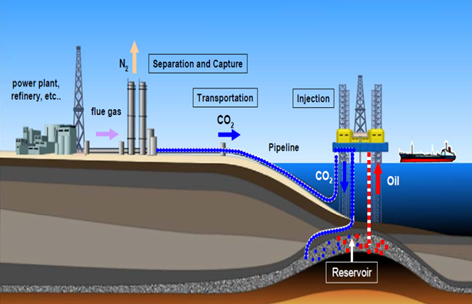
Fig. 6- Iniezione di CO2 in una piattaforma petrolifera
Potrebbero interessarti anche:
- CCS – Cattura e stoccaggio della CO2
- La separazione della CO2 dai gas combusti
- Polimeri metallo-organici (MOF) per la cattura della CO2
Bibliografia consultata
[1] www.iea.org
[2] F. Rossi, B. Castellani, A. Gambelli, E. Morini; Experimental Investigation on CO2 Methanation Process for Solar Energy Storage Compared to CO2-Based Methanol Synthesis, Energies 10, 2017.
[3] Enciclopedia Treccani,Enciclopedia degli idrocarburi, Vol II: Industria di base – Raffinazione e petrolchimica,(301-317), 2014.
[4] R. Pirone, F. Deorsola; Produzione di Dimetiletere (DME) attraverso idrogenazione catalitica diretta della CO2 in un singolo stadio, report, 2015
[5] C. Bassano, P. Deiana, G. Ferraro, N. Verdone, M. Martinelli, C.G. Visconti, L. Lietti, P. Forzatti; Tecnologie Coal and Biomass to Liquid: Analisi energetiche di processo e indagini sperimentali per lo sviluppo di nuovi catalizzatori della sintesi Fischer-Tropsch, ENEA, Report RdS/PAR2013/288
[6] M. Shelef; Selective Catalytic Reduction of NOx with N-Free Reductants; Chemical Reviews 1995, (209-225), 1995.
[7] M. Xu, A.R.Jupp, M.S.E. Ong, K. I. Burton, S. S. Chitnis, D. W. Stephan; Synthesis of Urea Derivatives from CO2 and Silylamines; Angewandte Chemie International Edition 58; (5707-5711); 2019.
Riutilizzo dell’anidride carbonica/Riutilizzo dell’anidride carbonica/Riutilizzo dell’anidride carbonica/Riutilizzo dell’anidride carbonica/Riutilizzo dell’anidride carbonica/Riutilizzo dell’anidride carbonica