Gli inquinanti secondari
Continuiamo il discorso sull’inquinamento ambientale già intrapreso con gli articoli L’inquinamento atmosferico e Gli inquinanti principali. Come anticipato, gli inquinanti secondari si formano a partire dai primari per mezzo di reazioni chimiche che avvengono in atmosfera.
Inquinanti secondari: lo smog fotochimico
Esempi di inquinanti secondari sono l’ozono (O3) ed il biossido di azoto (NO2) ma anche aldeidi, chetoni, perossidi, ecc. Più in generale in presenza di radiazione solare l’insieme dei composti formatosi a partire dagli inquinanti principali per reazioni fotochimiche viene definito smog fotochimico:
![]()
![]()
Tra gli effetti principali dello smog fotochimico ci sono il ciclo fotolitico dell’azoto che porta alla formazione di ozono troposferico e la formazione del perossiacetilnitrato comunemente detto PAN.


Il ciclo fotolitico dell’azoto
L’ozono che si trova nella parte di atmosfera denominata stratosfera (tra i 12 e i 50 km di quota) è il principale responsabile della vita sulla Terra. È infatti fondamentale per filtrare le radiazioni solari di modo che si verifichi il cosiddetto effetto serra, che ha permesso il riscaldamento del nostro pianeta portandolo a temperature medie tra i 15-20°C che hanno consentito il proliferare delle forme di vita (in sua assenza la temperatura media della Terra sarebbe stata di -18 °C).
Esiste tuttavia un secondo fenomeno di formazione di ozono, a bassa quota, che risulta particolarmente nocivo in quanto crea un secondo effetto serra “locale”, che porta alla formazione di una vera e propria cappa che surriscalda la zona ed ostacola la dispersione delle sostanze inquinanti: l’ozono troposferico (ovvero nella zona di atmosfera al di sotto dei 10 km di quota).
La formazione di ozono troposferico durante una giornata è un processo complesso che prevede l’interazione di numerosi fattori ma che può essere schematizzato nel “ciclo fotolitico dell’azoto“: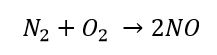
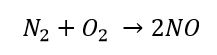
Nella prima reazione l’azoto molecolare si lega con ossigeno molecolare a formare due molecole di monossido di azoto.
![]()
![]()
Nella seconda reazione le due molecole di monossido di azoto legano nuovamente con ossigeno molecolare formando il biossido di azoto (come detto, inquinante secondario).
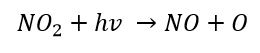
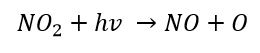
Il biossido di azoto in presenza di energia radiante hv con h= costante di Plank e v = frequenza della radiazione solare, si separa nuovamente in monossido di azoto e ossigeno puro.
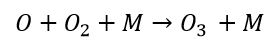
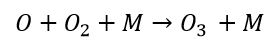
L’ossigeno singolo si lega nuovamente con ossigeno molecolare sfruttando nel processo una molecola generica M che assorba l’energia termica emessa rendendo stabile la reazione e forma ozono.
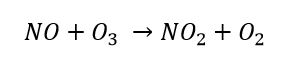
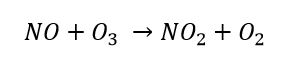
L’ozono si lega infine al monossido di azoto presente in atmosfera a formare nuovamente biossido di azoto e ossigeno molecolare.
Questo processo ciclico non è tuttavia stazionario, il che significa che il bilancio totale delle cinque reazioni non sarà nullo, questo perchè avviene ad orari del giorno diversi ed entrano in gioco altre specie chimiche per ora non citate per semplificare la comprensione.
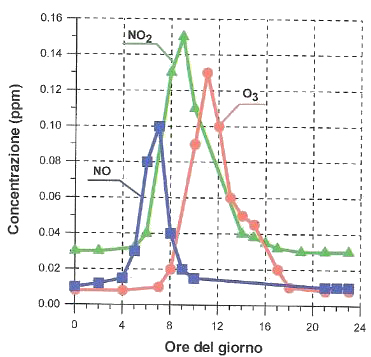

Andamento giornaliero delle concentrazioni di monossido di azoto, biossido di azoto e ozono troposferico in città [1]
Il perossiacetilnitrato (PAN)
Altro fenomeno facente parte dello smog fotochimico e ben più pericoloso del precedente è la formazione di perossiacetilnitrato, in sigla PAN. Questo composto è irritante per gli occhi e per le vie respiratorie e può provocare gravi danni alla flora. La formazione del PAN avviene mediante le seguenti reazioni: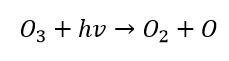
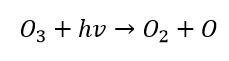
Inizialmente l’ozono si divide in ossigeno molecolare e nell’atomo di ossigeno singolo sfruttando l’energia radiante del Sole.
![]()
![]()
![]()
![]()
Dove R = radicale libero del tipo HC (come CH3 o C2H6), ed una volta separato dall’idrogeno risulta particolarmente reattivo e pronto a reagire con la molecola di acqua e l’ossigeno molecolare come segue.
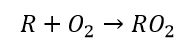
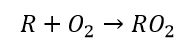
![]()
![]()
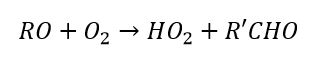
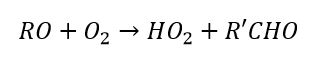
Dove R’ è il radicale libero che ha perso il gruppo HC.
![]()
![]()
Sommando le precedenti reazioni si ottiene:
![]()
![]()
Dove R’CHO è un aldeide.
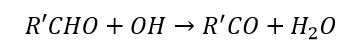
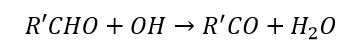
Il gruppo aldeide reagisce infine con il gruppo OH a formare R’CO che legandosi con ossigeno molecolare e biossido di azoto presente in atmosfera (si era formato in precedenza da NO), produce il R’COOONO2 ovvero il perossiacetilnitrato (PAN).
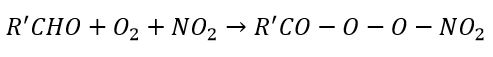
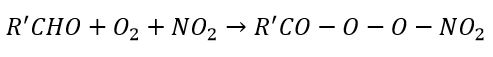
Terminiamo così la trattazione riguardante gli inquinanti secondari ricordando che si tratta principalmente di eventi su scala locale e che, nel caso trattato dello smog fotochimico, hanno luogo solo in presenza di luce solare (che fornisce l’energia necessaria per avviare le reazioni chimiche). Questo non significa che siano fenomeni da sottovalutare, al contrario sono pericolosi per la salute dei cittadini e vanno monitorati con prudenza.
Fonti
- Immagine di copertina
- [1] scan da: Giorgio Cau, Daniele Cocco, “L’impatto Ambientale dei Sistemi Energetici”- IV Edizione, SGEditoriali.
- Giorgio Cau, Daniele Cocco, “L’impatto Ambientale dei Sistemi Energetici”- IV Edizione, SGEditoriali.