Il rene artificiale, utopia o realtà?
L’insufficienza renale è una patologia sempre più diffusa che comporta l’incapacità da parte dei reni di adempiere correttamente alle proprie funzioni.
Il rene è infatti un organo che svolge funzioni molto importanti come la regolazione dell’osmolarità e dei liquidi corporei, il bilancio dell’equilibrio idrico-salino e acido-base, l’escrezione di prodotti terminali del metabolismo (ossia ripulisce il sangue dai prodotti di scarto) e la produzione e secrezione di importanti ormoni come l’eritropoietina.
 La perdita di funzionalità di entrambi i reni può essere acuta (reversibile) o cronica (irreversibile) e le principali soluzioni sono il trapianto o la dialisi.
La perdita di funzionalità di entrambi i reni può essere acuta (reversibile) o cronica (irreversibile) e le principali soluzioni sono il trapianto o la dialisi.
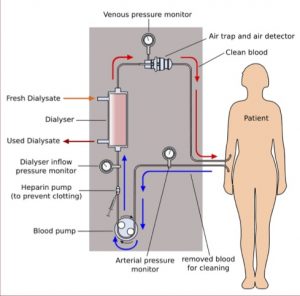
Il problema principale nasce dai tempi di attesa per trovare un nuovo organo disponibile per il trapianto e ciò costringe a ricorrere a soluzioni alternative come l’emodialisi.
Questa soluzione consiste nel dover fare lunghe sedute, più volte alla settimana, in strutture specializzate. Bisogna rimanere collegati ad un apparecchio esterno, in cui il sangue del paziente passa attraverso un filtro che rimuove i rifiuti pericolosi, i minerali e i liquidi in eccesso, riequilibra il bilancio acido-base ed elettrolitico.
Il cardine di questo dispositivo è il filtro dializzatore, un elemento a doppio comparto che contiene il sangue del paziente e il liquido dializzante , separati da una membrana semipermeabile. I prodotti di scarto ed gli elettroliti diffondono dal plasma al liquido di dialisi, che viene poi sostituito.
Il sangue così trattato viene restituito al corpo. In questo modo non si provvede però a nessuna funzione endocrina.
I PRIMI PROGRESSI
Negli ultimi decenni si è cercato di ovviare a questi problemi e nel 2007 a Vicenza, in Veneto, è nato il progetto del “Vicenza Wearable Artificial Kidney for Peri- toneal Dialysis (ViWAK PD)”.
Il sistema appare come una cintura a cui sono attaccati i piccoli dispositivi per la dialisi. E’ concepito per eseguire la continua dialisi peritoneale ambulatoriale (CAPD), richiedendo solo alcune operazioni la mattina e la sera, lasciando libero il paziente durante il giorno e la notte.
Prevede un miniaturizzato sistema per il flusso continuo con la rigenerazione del dialisato usato, attraverso un minicycler e un catetere a doppio lume.
 Al mattino il paziente carica la cavità peritoneale con 2 litri di soluzione dializzante fresca, dopo circa due ore, il ricircolo viene attivato per 10 ore alla velocità di circa 20ml/min. Alla fine di questo processo si ottiene un equilibrio perfetto nella rimanente soluzione. Per ottenere ultrafiltrazione, qualora fosse necessario, il glucosio può esser aggiunto alla cavità peritoneale attraverso un tubicino collegato a un piccolo serbatoio posto sulla cintura, funzione attivabile dal controllo remoto. Dopo 2 ore, il fluido viene scaricato e uno scambio di icodestrina da 2 litri viene effettuato durante la notte per ottenere una ultrafiltrazione ulteriore. Si tratta dunque, di un sistema di assorbimento giornaliero a batteria in cui il liquido dializzante ricircola e viene rigenerato per 10 ore. Usa un catetere a doppio lume caratterizzato da un particolare configurazione che assicura la minima ricircolazione peritoneale del fluido rigenerato nell’unità di riadsorbimento.
Al mattino il paziente carica la cavità peritoneale con 2 litri di soluzione dializzante fresca, dopo circa due ore, il ricircolo viene attivato per 10 ore alla velocità di circa 20ml/min. Alla fine di questo processo si ottiene un equilibrio perfetto nella rimanente soluzione. Per ottenere ultrafiltrazione, qualora fosse necessario, il glucosio può esser aggiunto alla cavità peritoneale attraverso un tubicino collegato a un piccolo serbatoio posto sulla cintura, funzione attivabile dal controllo remoto. Dopo 2 ore, il fluido viene scaricato e uno scambio di icodestrina da 2 litri viene effettuato durante la notte per ottenere una ultrafiltrazione ulteriore. Si tratta dunque, di un sistema di assorbimento giornaliero a batteria in cui il liquido dializzante ricircola e viene rigenerato per 10 ore. Usa un catetere a doppio lume caratterizzato da un particolare configurazione che assicura la minima ricircolazione peritoneale del fluido rigenerato nell’unità di riadsorbimento.

Il dispositivo consiste in un kit monouso progettato per ripulire fino a 12 litri di soluzione peritoneale. Il kit è dotato di un circuito con filtro sterile, un sensore di pressione di sicurezza e un pacco di cartucce di adsorbiti e una batteria ricaricabile. Il tutto è gestito da un sistema di controllo.
GLI ULTIMI PASSI VERSO IL FUTURO
All’inizio degli anni duemila negli Stati Uniti è nato “The Kidney Project”, sotto il controllo del direttore tecnico Shuvo Roy ,bioingegnere e professore della UCSF, e del direttore medicoWilliam Fissel , professore associato al Vanderbilt University Medical Center.
Si è cercato di creare un dispositivo bio-ibrido che imiti il comportamento del rene nella rimozione dei prodotti di scarto, acqua e sale, permettendo al paziente di non avere la necessità della dialisi. L’obiettivo è quello di realizzare un dispositivo abbastanza piccolo ( circa come una lattina di coca-cola ) in modo da poterlo inserire all’interno del corpo del paziente. 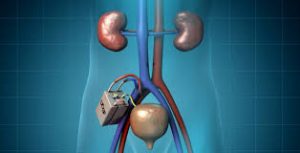
Si tratta di un rene artificiale autonomo, impiantabile chirurgicamente, in grado di provvedere alla maggior parte delle funzioni renali, compresa l’attività endocrina e metabolica, che nel caso di dialisi e Viwak non era permessa.
L’importante svolta sta nel fatto che questo dispositivo non richiede alcuna fonte di alimentazione esterna perché sfrutta la potenza del cuore del paziente e la pressione del flusso sanguigno per spingere il sangue attraverso i filtri. Un altro aspetto interessante è la collocazione fuori dalla portata della risposta immunitaria del corpo ed è quindi improbabile incorrere nel rigetto.
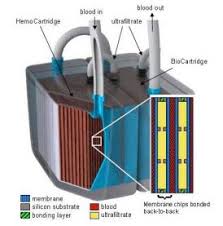 E’ stato un percorso lungo vent’anni che, dimostrando dapprima l’attuabilità dei componenti del rene artificiale, facendo studi e test sui componenti, ha portato alla progettazione dei primi prototipi e nel 2017 si è giunti finalmente al collaudo clinico con l’impianto nei pazienti volontari.
E’ stato un percorso lungo vent’anni che, dimostrando dapprima l’attuabilità dei componenti del rene artificiale, facendo studi e test sui componenti, ha portato alla progettazione dei primi prototipi e nel 2017 si è giunti finalmente al collaudo clinico con l’impianto nei pazienti volontari.
E’ costituito da due parti principali: l’emofiltro, per la filtrazione glomerulare, e il bioreattore, che assolve a funzioni metaboliche e di riassorbimento.
EMOFILTRO
Ha la funzione di rimuovere tossine e ristabilire l’equilibrio idrico-salino. Sono state usate delle membrane biomimetiche che usano nanotecnologie di silicone per riprodurre i filtri del rene umano, le SNM (= silicon nanopore membranes) costruite con la tecnologia MEMS, che permettono alta selettività e permeabilità usando solamente la pressione di prefusione, senza l’ausilio di batterie o pompe, al contrario delle fibre di polimeri utilizzati nei comuni filtri ematici.
I pori, di dimensioni tra 5-90nm, sono generati per mimare la geometria delle fenditure tra i podociti glomerulari.
![]()
Le membrane, ricoperte di titanio, sono incolonnate a formare filtri paralleli e, per impedire l’attaccamento delle proteine globulari, la superficie di silicio è ricoperta da uno strato di glicole polietilenico (PEG), motivo per cui non servono anticoagulanti.
Questi filtri sono costituiti da microchip, i quali sono sono accessibili, poco costosi, accurati e ogni dispositivo ha una quindicina di strati di microchip di filtraggio, uno sopra l’altro.
BIOREATTORE
Il rene, tra le sue funzioni principali, ha quella di riassorbire la maggior parte delle sostanze che filtra, come sali, acqua, amminoacidi, zuccheri, che se fossero escrete porterebbe alla perdita di una grande quantità di sostanze fondamentali per l’organismo. Vengono invece eliminate le tossine, prodotti di scarto del metabolismo, e tutte le sostanze in eccesso attraverso l’urina. Questo dispositivo provvede al riassorbimento di grandi volumi di sali e acqua, alla autoregolazione della pressione sanguigna e produzione di vitamina D, e per tale scopo vengono usate le cellule renali del tubulo contorto prossimale. Queste ultime svolgono le loro consuete funzioni, come se fossero in un rene umano e non in un bioreattore. Ma da dove derivano queste cellule? Sono estratte da reni donati che non possono essere trapiantati perché troppo affaticati o con problemi ai vasi sanguigni. Queste, dunque, derivano da organi viventi, coltivate in laboratorio e poi poste all’interno del bioreattore.
Le cellule sono impiantate su un’impalcatura di SNM e si sostentano grazie al passaggio di sostanze attraverso la membrana stessa.
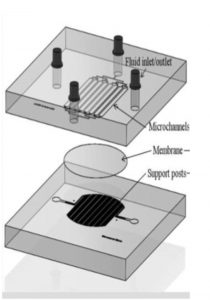
Questo dispositivo è formato da due parti. Una camera apicale che contiene 8 microcanali paralleli per la perfusione delle cellule e una camera inferiore che funge come serbatoio per il trasporto attraverso le cellule e sostentamento della membrana su cui crescono le cellule. Questo sistema è capace di trasdurre i segnali meccanici (gli sforzi di taglio) in segnali biomedici che regolano il trasporto di soluti.